搜索
MaxNuclease全能核酸酶及MaxNuclease ELISA Kit
MaxNuclease全能核酸酶 (DMF Filed)
随着生物医药领域的迅猛发展,生物制品的种类日益趋增。与此同时,生物制品也有着严格的质控体系,其中,残留核酸是国内外药品监管机构的关注重点。AAV载体、抗体药、疫苗、重组蛋白药等制品是用连续传代的细胞表达生产,即使经过精细的纯化工艺,制品中也有可能残留宿主核酸,残留的核酸可能会带来致病、致瘤等风险。我国对生物制品中的核酸残留做了严格要求,2020版《中国药典》中明确指出酵母、大肠杆菌表达的生物制品的核酸残留不超过10ng/剂;CHO细胞表达的重组乙肝疫苗、人促红素的核酸残留不超过10pg/剂、100pg/10000IU;Vero细胞表达的狂犬疫苗的核酸残留不超过3ng/剂等。
此外,CAR-T细胞治疗行业、慢病毒的大规模纯化、蛋白提取等领域都需要严格控制核酸的残留。
目前,核酸去除的方法主要有酶解法、聚乙烯亚胺(PEI)沉淀法、离子交换层析等。酶法中的全能核酸酶因高效、经济、操作简便等优势广受青睐。
恺佧生物提供GMP级全能核酸酶—MaxNuclease,参照药典标准进行开发和验证,生产过程完全按照GMP生产标准进行,保证生产流程原材料的可追溯。目前,该产品已通过美国FDA DMF备案,DMF编号为036799,主要内容涉及生产工艺和过程控制、物料控制等方面。
产品特点
- GMP级别产品,药典标准放行检测,满足从研发到商业大规模生产的使用需求
- 按照药典标准的检测方法学开发和验证,无抗生素残留,不使用含动物源原材料
- 高标准的CGT蛋白酶GMP生产车间
- 高纯度、高活性,可消化任何形式的DNA和RNA
- 符合申报要求,可提供申报用文件
- 工艺验证、稳定性验证严格参考法规要求
- 完整的批生产和QC记录
质量要求
| 项目 | 标准 | 检测方法 |
|---|---|---|
| 外观 | 无色透明溶液 | 目视检查 |
| 活性 | ≥250 U/μl | 消化鲑鱼精 DNA 法 |
| 比活 | ≥1.1×106 U/mg | 活性和蛋白质量浓度比值 |
| 纯度 | ≥95% | Tris-Bis PAGE |
| ≥99% | SEC-HPLC | |
| 蛋白酶残留 | 无检出 | 蛋白酶底物与样品孵育 |
| 重金属残留 | ≤10 ppm | 中国药典2020版第四部重金属检查法通则 (0821) |
| 细菌内毒素含量 | ≤0.01 EU/1kU | 显色法 |
| 宿主蛋白残留 | ≤10 ppm | 酶联免疫法 |
| 无菌检查 | 无检出 | 中国药典2020版第四部无菌检查法 通则 (1101) |
| 支原体 | 无检出 | 支原体检查法(qPCR荧光定量分析) |
| pH | 8.0 | 中国药典2020版第四部pH值测定法通则 (0631) |
产品应用
- 去除生物制品中的核酸残留
- 适用于病毒的纯化,如慢病毒、AAV、溶瘤病毒等
- 降低细胞裂解液和细胞上清的粘度,减少处理时间,提高蛋白产量
- 防止细胞结团
产品数据
纯度
Kactus
Bis-Tris PAGE(≥95%)
SEC-HPLC(≥99%)

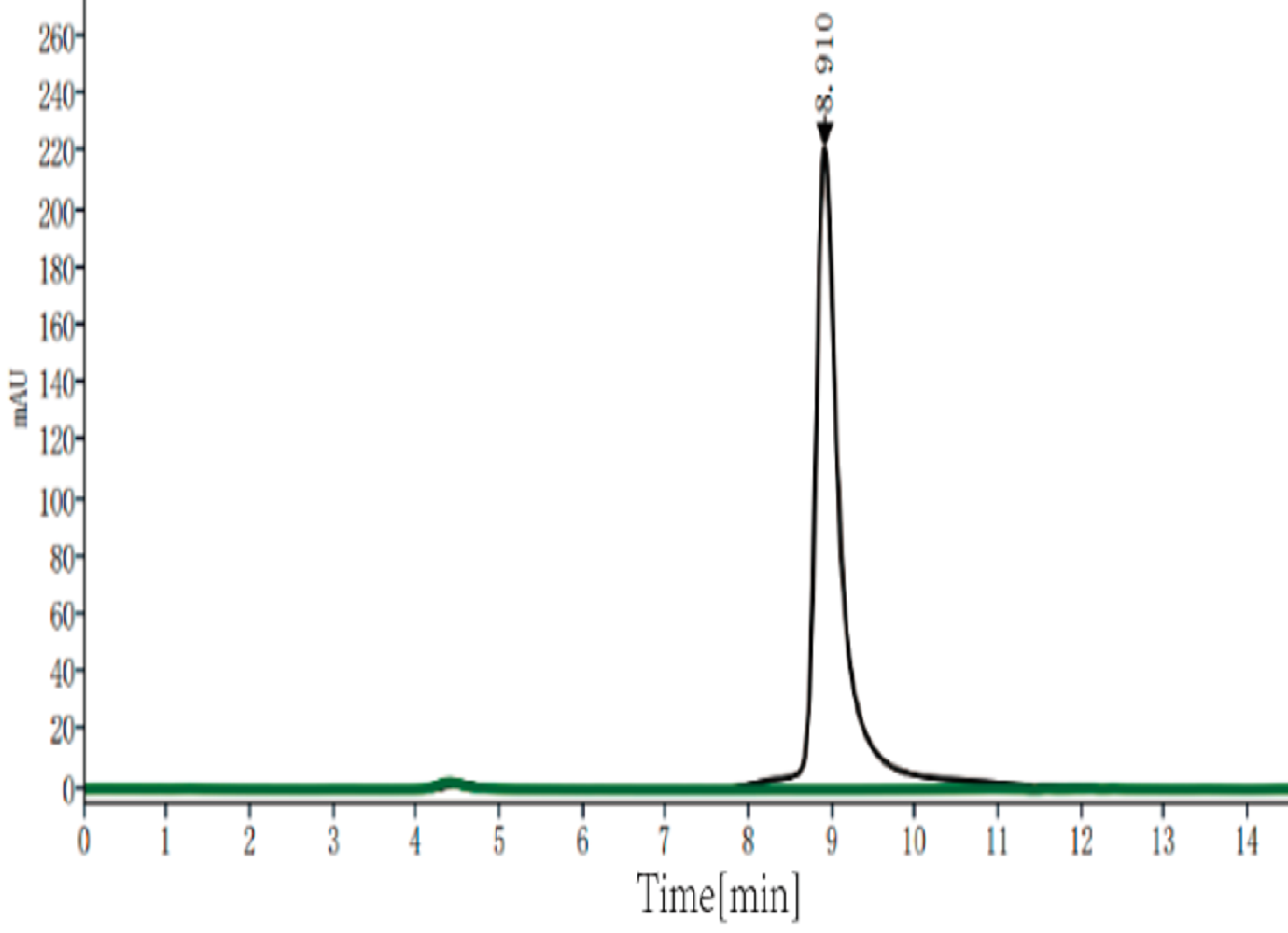
Fig. 1 通过Bis-Tris PAGE和SEC-HPLC验证,MaxNuclease纯度分别≥95%、≥99%。
降解核酸效果
Kactus
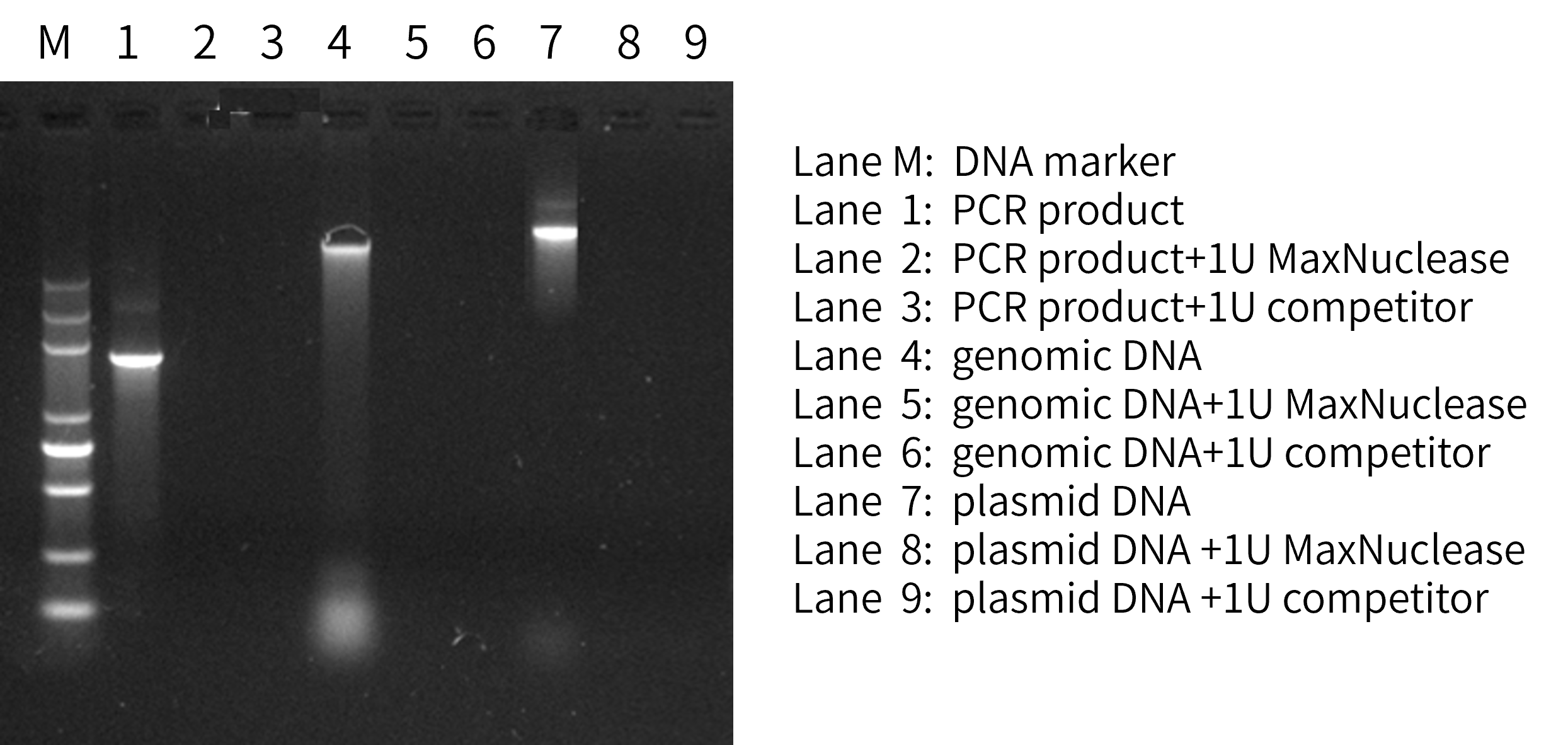
Fig. 2 MaxNuclease可降解PCR产物、gDNA、质粒、RNA等任何形式的核酸。
MaxNuclease ELISA Kit
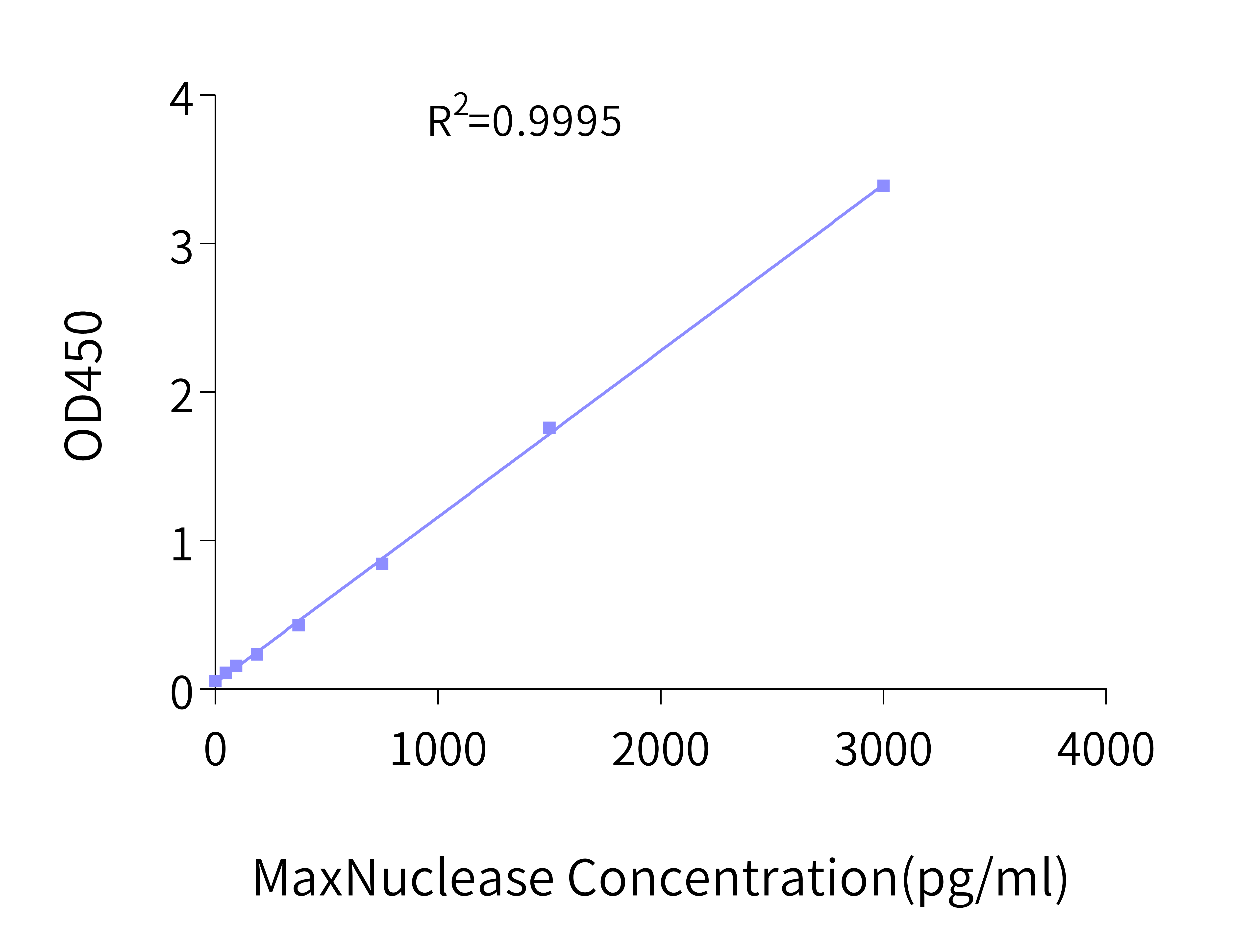
病毒载体和疫苗等生物制品经MaxNuclease去除核酸后,也需对体系中MaxNuclease的残留进行评估。为此,恺佧生物精心开发了高灵敏、高特异性的残留检测试剂盒MaxNuclease ELISA Kit, 其灵敏度可达23 pg/ml。
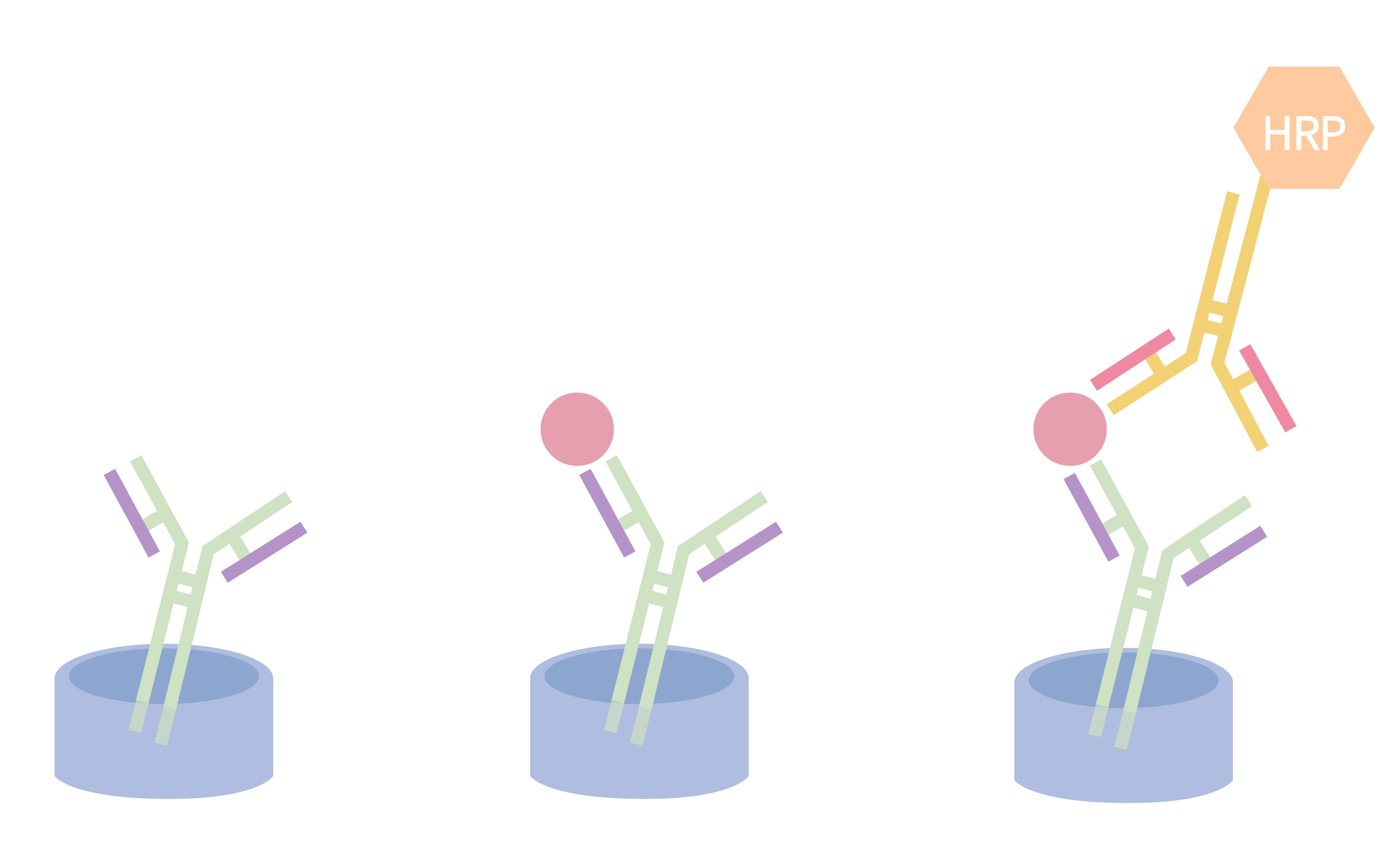
MaxNuclease ELISA Kit检测原理(双抗夹心法)
标准曲线绘制示例
产品列表
| 货号 | 名称 | 种属 | 表达体系 | 规格 | |
|---|---|---|---|---|---|
| NUC-SE101 | MaxNuclease全能核酸酶 | S. Marcescens | E.coli | 50KU/250KU/5MU | 立即询价 |
| GMP-NUC-SE101 | MaxNuclease全能核酸酶(GMP grade) | S. Marcescens | E.coli | 250KU/5MU | 立即询价 |
| NUC-SE00B | MaxNuclease ELISA Kit | / | / | 96T | 立即询价 |






